Phản ứng este hóa là 1 phản xạ chất hóa học cần thiết, nhập vai trò chính yếu vô phát hành este, một group thích hợp hóa học cơ học sở hữu tầm quan trọng vĩ đại rộng lớn vô cuộc sống. Este là bộ phận chủ yếu của khá nhiều thành phầm như nước hoa, nguyên liệu, thức ăn, chất làm đẹp,… Trong nội dung bài viết tiếp sau đây lpavietnam.edu.vn tiếp tục thực hiện rõ rệt và cụ thể nhất về định nghĩa, vai trò, phần mềm, và một vài ba dạng bài xích tập luyện áp dụng.
Định nghĩa phản ứng este hóa

Bạn đang xem: phản ứng este hóa
Phản ứng este hóa là 1 quy trình chất hóa học cơ phiên bản điểm tuy nhiên axit cacboxylic ứng dụng với ancol vô ĐK sở hữu hóa học xúc tác axit, đưa đến este và nước. Đây là 1 phần luôn luôn phải có vô ngành chất hóa học cơ học, với hình thức giản dị tuy nhiên lại banh đi ra vô số phần mềm vô thực tiễn.
Tầm cần thiết của phản ứng este hóa
Phản ứng este hóa đóng góp một tầm quan trọng cần thiết trong vô số nhiều nghành nghề dịch vụ của cuộc sống và công nghiệp. Dưới đó là một vài phần mềm chủ yếu của phản ứng este hóa:
- Sản xuất este: Este là thích hợp hóa học cơ học xuất hiện thoáng rộng trong vô số nhiều thành phầm kể từ hóa chất làm đẹp cho tới thức ăn. Hương liệu và hóa học tạo nên mùi thơm nội địa hoa, dầu gội, sữa tắm, và thức ăn đó là dựa vào những loại este được tổ hợp qua loa phản ứng este hóa.
- Ứng dụng vô chất hóa học hữu cơ: Phản ứng este hóa là dụng cụ mạnh mẽ và tự tin trong những việc tổ hợp những thích hợp hóa học cơ học, kể từ những thích hợp hóa học sử dụng vô chống thực nghiệm cho tới những hóa học sử dụng vô phát hành công nghiệp và dược phẩm. Sự đa dạng và phong phú của este và tính linh động vô phản ứng este hóa được chấp nhận bọn chúng được dùng muốn tạo đi ra nhiều thích hợp hóa học cơ học phức tạp không giống.
- Công nghiệp dược phẩm: phần lớn loại thuốc chữa bệnh và dược phẩm được tổ hợp trải qua những phản ứng este hóa. Este thông thường được dùng như thể hóa học vận gửi hoạt hóa học hoặc canh ty tăng nhanh tính hòa tan của dung dịch.
- Công nghiệp hóa chất: Este cũng chính là bộ phận cần thiết trong những việc phát hành nhiều loại hóa hóa học công nghiệp, kể từ hóa học thực hiện mượt cho tới hóa học chống bào mòn.
Cơ chế của phản xạ este hoá
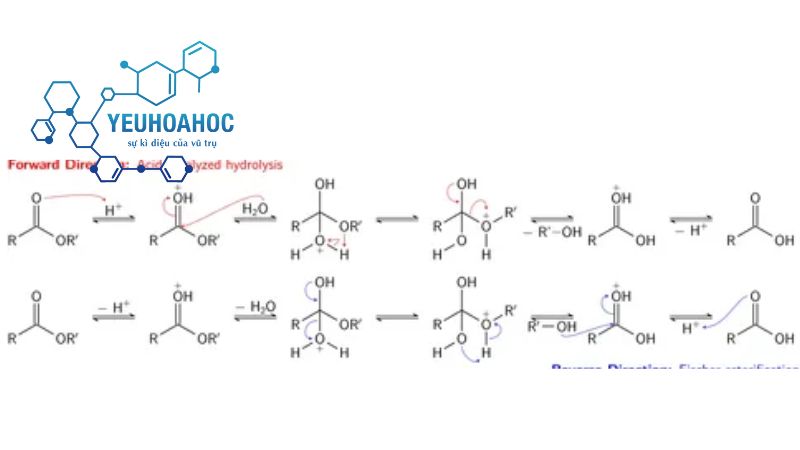
Cơ chế phản ứng este hóa là 1 quy trình bao gồm nhì quá trình chủ yếu, ra mắt bên dưới tác dụng của nhiệt độ chừng và hóa học xúc tác axit.
Giai đoạn 1: Hình trở thành phức trung gian:
- Axit cacboxylic và ancol kết phù hợp với nhau tạo nên trở thành phức trung gian ngoan.
- Phức trung gian ngoan này là 1 ion dương sở hữu cấu hình vững chắc và kiên cố.
Giai đoạn 2: Phân tung phức trung gian:
- Phức trung gian ngoan phân tung trở thành este và nước.
- Sản phẩm chủ yếu của phản ứng este hóa là este.
Những nguyên tố tác động cho tới phản ứng este hóa
Có tía nguyên tố chủ yếu tác động cho tới phản ứng este hóa:
Nồng chừng axit: Việc tăng mật độ axit vô phản xạ hoàn toàn có thể tăng nhanh vận tốc phản xạ và hiệu suất gửi hóa trở thành este.
Nhiệt độ: Nhiệt chừng cao hơn nữa xúc tiến quy trình phản xạ ra mắt nhanh chóng rộng lớn, tuy nhiên cũng cần phải chú ý tới việc ổn định ấn định của những hóa học nhập cuộc và thành phầm.
Cấu tạo nên este: Cấu trúc phân tử của axit và ancol ban sơ cũng tác động cho tới kĩ năng tạo hình este. Các group chức và chuỗi cacbon lâu năm hoàn toàn có thể tác động tới việc đơn giản và hiệu suất của phản xạ.
Phân loại và phần mềm của phản ứng este hóa vô chất hóa học hữu cơ
Phản ứng este hóa là 1 trong mỗi quy trình chất hóa học cơ phiên bản, đóng góp một tầm quan trọng luôn luôn phải có vô ngành chất hóa học cơ học và có khá nhiều phần mềm cần thiết vô thực tiễn. Có nhì phân loại chủ yếu của phản ứng este hóa phụ thuộc loại hóa học tham lam gia: este hóa thân thiện axit cacboxylic và ancol, và este hóa thân thiện axit cacboxylic và anhyđrit axit. Mỗi loại phản xạ sở hữu những ví dụ và phần mềm riêng không liên quan gì đến nhau, phản ánh tính đa dạng và phong phú và linh động của phản ứng este hóa.
Este hóa thân thiện axit cacboxylic và ancol
Phản ứng este hóa thân thiện axit cacboxylic và ancol là quy trình chất hóa học cơ phiên bản nhất, đưa đến este và nước như thành phầm. Phản ứng này thông thường cần dùng hóa học xúc tác axit như axit sulfuric nhằm tăng vận tốc phản xạ.
Ví dụ: Khi axit axetic (CH₃COOH) phản xạ với etanol (C₂H₅OH) bên dưới ĐK sở hữu axit sulfuric thực hiện hóa học xúc tác, thành phầm tạo nên trở thành là etyl axetat (CH₃COOC₂H₅), một loại este sở hữu mùi hương thơm nức đặc thù.
Ứng dụng: Este hóa thân thiện axit cacboxylic và ancol có khá nhiều phần mềm cần thiết, đặc biệt quan trọng vô ngành công nghiệp hóa chất làm đẹp và thức ăn. Etyl axetat được dùng như 1 dung môi trong vô số nhiều loại đạp, mực in và là bộ phận trong vô số nhiều nguyên liệu thức ăn.
Este hóa thân thiện axit cacboxylic và anhyđrit axit
Phản ứng este hóa thân thiện axit cacboxylic và anhyđrit axit là quy trình tạo nên este trải qua phản xạ của một axit cacboxylic với anhyđrit của một axit không giống. Phản ứng này thông thường ra mắt nhanh chóng rộng lớn và ko đưa đến nước như thành phầm phụ, thực hiện tăng hiệu suất phản xạ.
Ví dụ: Phản ứng thân thiện axit axetic (CH₃COOH) và anhyđrit axetic (CH₃CO)₂O đưa đến etyl axetat (CH₃COOC₂H₅) và axit axetic dư. Phản ứng này ra mắt tuy nhiên ko cần dùng hóa học xúc tác và ko đưa đến nước.
Ứng dụng: Este hóa thân thiện axit cacboxylic và anhyđrit axit thông thường được dùng vô tổ hợp chất hóa học cơ học, đặc biệt quan trọng trong những việc phát hành những thích hợp hóa học cơ học phức tạp. Như vậy hoàn toàn có thể bao hàm tổ hợp những loại thuốc chữa bệnh, thích hợp hóa học sử dụng vô nông nghiệp và hóa hóa học tinh nghịch khiết mang đến nghiên cứu và phân tích khoa học tập.
Cách giải bài xích tập luyện phản xạ este hoá
Bài tập luyện review hiệu suất phản ứng este hóa
Hiệu suất phản ứng:
Bài toán tính lượng este
Nếu vấn đề là lếu láo thích hợp những ancol hoặc axit => tính theo gót M (trung bình)
Bài tập luyện áp dụng
Dạng 1: Tính số mol este theo gót lý thuyết
Ví dụ:
Cho 10 gam axit axetic ứng dụng với 6,9 gam etanol (có
đặc thực hiện hóa học xúc tác), nhận được 8,7 gam este. Tính lượng mol este theo gót lý thuyết.
Lời giải:
ban đầu 0,167 mol 0,15 mol
phản ứng 0,15 mol 0 ,15 mol
sau phản ứng 0,017 mol 0
So sánh số mol:
=> Etanol là hóa học phản xạ không còn. còn axit axetic dư 0,017 mol
nên số mol este tiếp tục tính theo gót hóa học phản xạ hết
= 0,15 mol.
Xem thêm: code gold tower defence
Vậy số mol este theo gót lý thuyết là 0,15 mol.
Dạng 2: Tính toán hiệu suất của phản ứng este hóa.
Ví dụ:
Cho 30 gam axit axetic ứng dụng với 23 gam etanol (có
đặc thực hiện hóa học xúc tác), nhận được 26,4 gam este. Xác ấn định hiệu suất của phản ứng este hóa.
Lời giải:
ban đầu 0.5mol 0,5 mol 0,5mol
theo đề bài xích tao có:
Theo phương trình phản xạ ⇒
= 0,5 mol.
theo phương trình
= 0,5 mol ⇒
= 0,5 * 88 = 44
Do cơ, tỷ trọng hiệu suất của phản ứng este hóa là 60,22%.
Dạng 3: Tính lượng este
Ví dụ:
Cho 15 gam axit axetic ứng dụng với 9,2 gam etanol (có
đặc thực hiện hóa học xúc tác), nhận được este. Tính lượng este nhận được.
Lời giải:
ban đầu 0.25 mol 0,2 mol
phản ứng 0,2 mol 0 ,2 mol 0,2
sau phản ứng 0,05 mol 0
theo đề bài xích tao có:
So sánh số mol:
=> Etanol là hóa học phản xạ không còn. còn axit axetic dư 0,05 mol
nên số mol este tiếp tục tính theo gót hóa học phản xạ hết
= 0.2 mol.
Tính lượng este:
Xem thêm: sinh quyển là gì
= 0,2 * 88 = 17,6 gam.
Vậy lượng este nhận được là 17,6 gam.












Bình luận